原发性家族性脑钙化研究取得进展
本文转自:中科院之声
6月17日, Neuroscience Bulletin在线发表了题为Mechanisms of PiT2-loop7 Missense Mutations Induced Pi Dyshomeostasis的研究论文 。 该研究由中国科学院脑科学与智能技术卓越创新中心(神经科学研究所)、神经科学国家重点实验室刘静宇研究组、竺淑佳研究组和华中科技大学合作完成 。 研究结果显示, PiT2-loop7结构域错义突变通过影响PiT2磷酸化而阻碍其向细胞表面转运, 引起细胞磷稳态失衡, 从而导致原发性家族性脑钙化(primary familial brain calcification, PFBC), 揭示了PiT2-loop7结构域磷酸化修饰对PiT2生理功能的重要影响 。
PFBC是一种以基底神经节和/或其它脑区对称性钙化为主要特征的具有高度遗传和临床异质性的神经退行性疾病, 患者临床症状主要包括运动障碍、认知障碍、神经精神障碍以及头痛等, 目前没有有效治疗方法 。 SLC20A2是PFBC最主要的致病基因, 该基因编码的PiT2蛋白能够依赖钠离子(Na+)的浓度梯度将细胞外的无机磷(Pi)转运至细胞内, 维持细胞Pi稳态 。 该基因突变导致脑内Pi稳态失衡是PFBC的致病基础 。
PiT2由652个氨基酸组成, 包含两个分别位于其N端和C端的PD结构域以及一个位于两者之间由248个氨基酸组成的胞内亲水结构域(PiT2-loop7) 。 研究表明, PD结构域在Pi转运过程中发挥重要作用, 而PiT2-loop7结构域功能知之甚少 。 目前已发现147个SLC20A2致病突变大部分分布在PD结构域;部分突变发生在PiT2-loop7结构域, 并且大多是移码或无义突变, 引起C端PD结构域丧失 。 上述与PD结构域相关的突变引起PiT2蛋白Pi转运活性下降, 导致细胞外Pi积累而引发PFBC;曾有研究显示, PiT2-loop7结构域删除不影响PiT2蛋白Pi转运功能, 发生在PiT2-loop7结构域的错义突变(p.S283R、p.R382Q、p.T390A、p.H399P和p.S434W)如何导致PFBC发生?
为探究PiT2-loop7结构域错义突变导致PFBC发生的分子机制, 科研人员以该结构域错义突变p.T390A和p.S434W为主要研究对象, 同时以PD结构域错义突变p.S121C和p.S601W为对照, 通过放射性Pi吸收和电生理实验证实, PiT2-loop7结构域错义突变与PD结构域错义突变类似, 均可影响PiT2蛋白Pi转运;进一步亲和力检测发现, PiT2-loop7结构域p.T390A和p.S434W突变不影响PiT2与底物Pi和Na+的结合, 而PD结构域p.S121C和p.S601W突变影响PiT2与底物Pi而非Na+的结合 。 结合生物信息学分析、免疫印迹和免疫荧光实验发现, PiT2-loop7结构域p.T390A和p.S434W突变分别影响AMPK和AKT介导的PiT2磷酸化, 进而影响PiT2在细胞膜上的定位 。 在PFBC患者中发生在PiT2-loop7结构域其它错义突变(p.S283R、p.R382Q和p.H399P)也是通过影响PiT2磷酸化和细胞膜定位而降低PiT2转运活性引发PFBC 。
该研究证实PiT2-loop7结构域错义突变影响磷酸化调节的PiT2细胞膜定位而降低细胞Pi转运活性;而PD结构域错义突变干扰PiT2与底物Pi的结合, 使细胞Pi转运活性受损(图1) 。 该研究加深了对PFBC致病机制的理解, 并为相关治疗药物的研发提供了理论基础 。
【原发性家族性脑钙化研究取得进展】研究工作得到国家自然科学基金委员会、科技部、上海市的资助 。
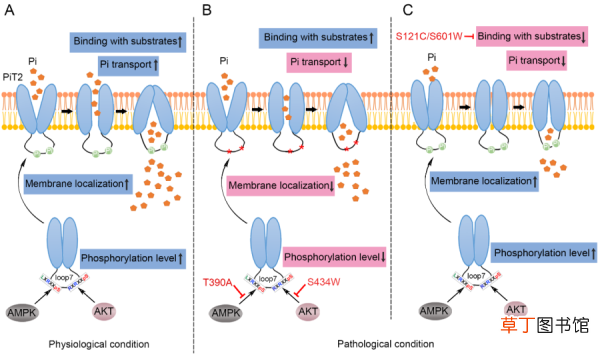
PiT2不同结构域突变导致细胞Pi稳态失衡的预测模型 。 (A)在生理条件下, Pi转运过程中活化的AMPK和AKT介导PiT2磷酸化, 进而促进其在细胞膜上的定位并发挥其Pi转运功能;(B, C)在病理条件下, PiT2-loop7结构域错义突变p.T390A和p.S434W可以通过影响AMPK和AKT介导的PiT2磷酸化, 降低PiT2的上膜, 进而导致Pi稳态失衡(B), 而PD结构域错义突变p.S121C和p.S601W可以通过影响PiT2与底物Pi的结合, 进而导致Pi稳态失衡(C)
推荐阅读
- 良性脑膜瘤能活多久,良性脑膜瘤术后20天死亡
- 结婚不能算是两个人的事情,是涉及到两个大家族两个家庭的结合
- 亡尸家族哪个分部历害
- 不夜天城是哪个家族的,不夜天之战
- 拉菲酒庄属于哪个家族,拉菲是什么阵营的
- 测你属于哪个巫师家族,测试你是巫师还是麻瓜
- 中国哪个家族掌权
- 罗青羊是哪个门派,罗青羊是哪个家族的
- 极乱家族在线哪里能看
- 闭嘴家族哪里可以看,闭嘴家族39集